Argomenti
correlati
NanoLuc® Luciferase: One Enzyme, Endless Capabilities ›
Notice: Promega will be performing essential system updates January 21–25.
Order processing and shipping will pause starting January 21 at 4:00 PM CST and resume on January 26.
Please plan to order in advance for any products needed during this timeframe.
Please contact Customer Service with any questions.
It looks like you are having trouble logging in, please try our dedicated login page.
Thank you for verifying your email address.
There was an issue verifying your email address. Please try again or contact Customer Service.
12.10.20 – Giacomo Grisafi
Come si comportano le proteine nel loro contesto intracellulare e nei tessuti? Lo sviluppo della tecnologia NanoLuc® ha fornito ai ricercatori strumenti nuovi e maggiormente efficaci per studiare la biologia in sistemi endogeni.
Questa piccola luciferasi (~ 19kDa) infatti, derivata dal gambero Oplophorus gracilirostris che vive nelle profondità oceaniche, offre diversi vantaggi rispetto alle tradizionali luciferasi Firefly o di Renilla.
Scopriamo quali in questo articolo.
Le piccole dimensioni di NanoLuc®, così come la sua chimica ATP indipendente, la rendono particolarmente attraente come reporter tag per esperimenti di bioluminescenza e imaging in vivo, sia su cellule che su animali. È infatti meno probabile che l'espressione di una piccola molecola reporter interferisca con la funzione biologica della proteina bersaglio. Non solo, da NanoLuc® è nata poi la tecnologia NanoBiT®, che parte proprio da questo approccio per spingersi oltre, generando un sistema reporter di complementazione per lo studio delle interazioni proteiche in cui le ridotte dimensioni dei tag sono la chiave per il successo sperimentale, oppure il sistema HiBiT® che sfrutta la stessa dinamica di complementazione ma al fine di quantificare proteine espresse anche a livelli molto bassi con precisione e sensibilità altrimenti impossibili. Guardate questo video.
Una delle prime applicazioni di NanoLuc® nell'imaging in vivo è stata lo studio delle infezioni virali. Nel 2013, Il miocrobiologo e immunologo Tran ha riportato lo sviluppo di un virus reporter per studi su modelli murini di influenza di tipo A . Le precedenti tecniche di imaging in bioluminescenza avevano in passato mostrato gravi limitazioni in termini di stabilità e sensibilità in vivo. Il virus reporter NanoLuc® ha invece mostrato nei topi caratteristiche identiche a quelle del virus influenzale A, rendendo il modello sperimentale molto più accurato. Utilizzando NanoLuc® i ricercatori sono stati in grado di monitorare la carica virale e la diffusione del virus nei polmoni, dimostrandone il potenziale impatto sulla terapia antivirale.
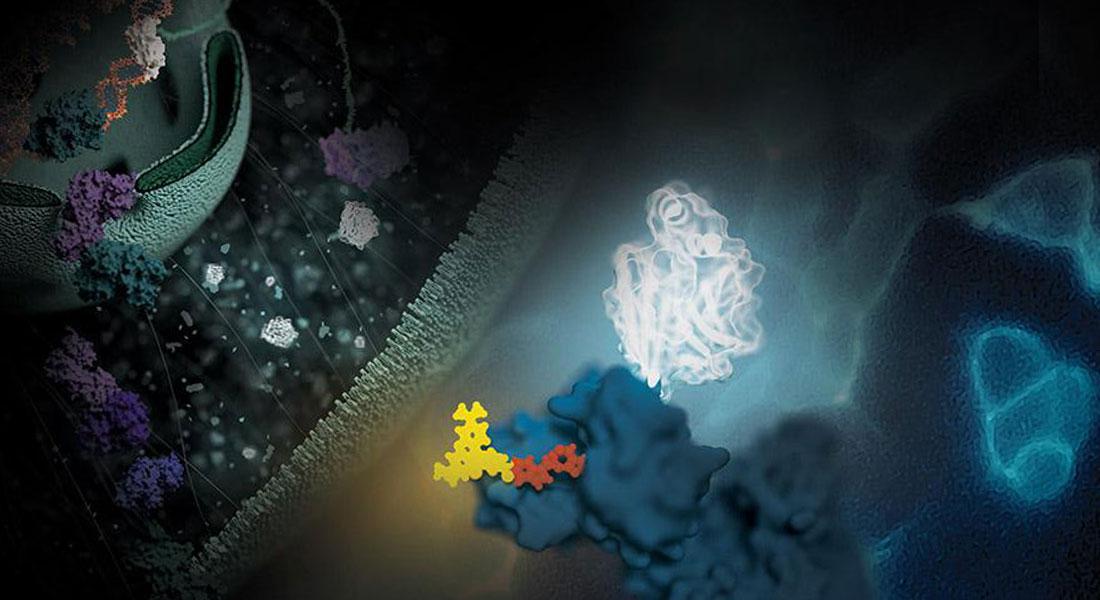
In uno studio più recente sempre riguardante i virus reporter, si è scoperto come migliorare ulteriormente questa applicazione utilizzando HiBiT®. In questo articolo, i ricercatori hanno inserito il tag HiBiT in un genoma di adenovirus oncolitico modificato, sotto il controllo del promotore virale E3 (che viene attivato dalla proteina virale E1A subito dopo l'infezione). Per dimostrare la stabilità e la funzionalità del virus reporter i ricercatori hanno infettato linee cellulari di cancro alla prostata sia aderenti che in sospensione, ingegnerizzate per esprimere il peptide LgBiT complementare. A sole 24 ore di distanza dall'infezione, il team ha potuto osservare una perfetta ricostituzione dell'attività luciferasica in tutte le linee cellulari testate, dimostrando quindi in maniera semplice e veloce l'avvenuta infezione.
Una sfida nell'utilizzo della bioluminescenza per l'imaging di tumori solidi o altri tessuti è la lunghezza d'onda di emissione della reazione bioluminescente. L'emoglobina assorbe principalmente nelle regioni blu e verde dello spettro visibile; quindi, una reazione bioluminescente ideale emetterebbe luce nella regione rossa più lontana. La luminescenza di NanoLuc® ha il suo picco a 460 nm, nella regione blu e questo potrebbe costituire un limite in confronto ad esempio alla fluorescenza, che può avere emissioni più adatte per il contesto. Il problema però è che anche la fluorescenza, all'interno di tessuti, è inevitabilmente esposta ad effetti di autofluorescenza aspecifica, oltre al fatto che è necessario eccitare i fluorofori per poterne generare l'emissione, cosa che con la chemiluminescenza non è necessaria.
Una tecnologia che può quindi fondere i plus di entrambi gli approcci è quella bastata sul trasferimento energetico da fonte bioluminescente (BRET); le piccole dimensioni di NanoLuc®, da utilizzare come donatore per un fluoroforo con emissione spostata oltre i 600nm e quindi ideale per i tessuti, costituiscono una combinazione ideale. Nella BRET l'energia sprigionata dalla reazione chemiluminescente viene trasferita ad un accettore fluorescente, ma perché ciò accada le due molecole devono essere molto vicine. Nel caso di NanoBRET poi, essendo la chimica NanoLuc® indipendente dall'ATP, può essere utilizzata anche in applicazioni BRET in cui il reporter è espresso in ambiente extra-cellulare, aprendo nuove strade nello studio delle interazioni molecolari che si verificano sulla superficie delle cellule.
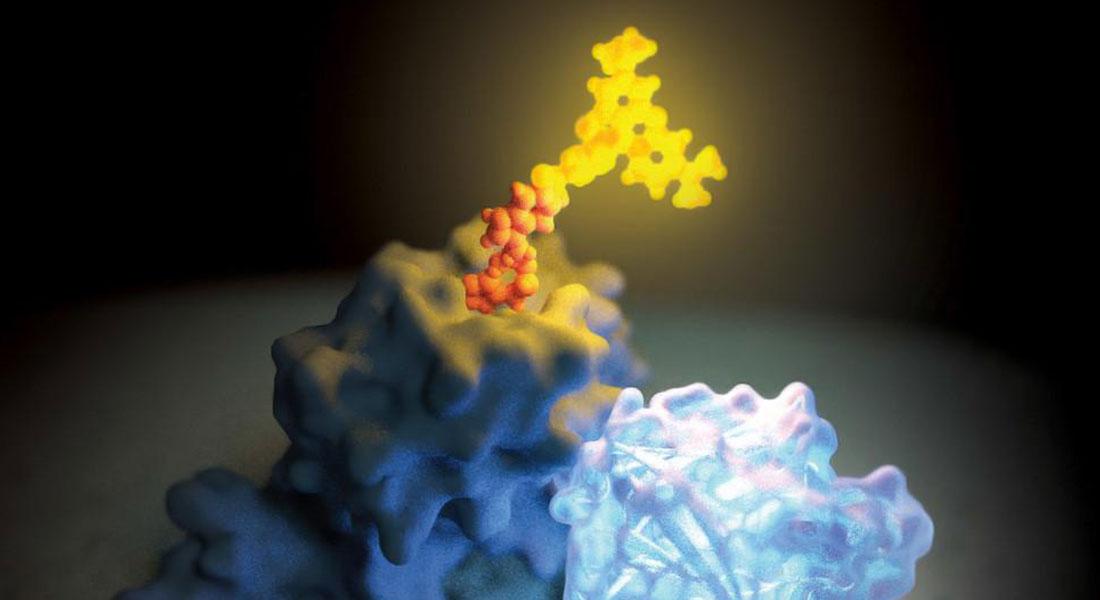
Yu Tang, divisione Farmacoterapia dell'Università della Nord Carolina, ha utilizzato la NanoBRET per studiare il legame tra anticorpi terapeutici e recettori negli animali vivi. Per farlo, il team ha fuso NanoLuc® all'estremità N-terminale del recettore del fattore di crescita epidermico (EGFR), utilizzando poi il dye fluorescente DY605 legato in modo covalente all'anticorpo terapeutico cetuximab come accettore di energia. Mentre il dosaggio di furimazina in sola presenza della proteina di fusione NanoLuc®-EGFR ha determinato il picco di emissione previsto a 460 nm, il legame dell'anticorpo ha prodotto un picco aggiuntivo a 625 nm. La separazione tra questi due picchi di emissione è stata poi ideale per un rilevamento affidabile, preciso e sensibile dei livelli di interazione.
Per gli esperimenti in vivo, i ricercatori hanno esaminato l'occupazione del recettore e la farmacocinetica di cetuximab utilizzando un modello di xenotrapianto tumorale su topi. Il team ha osservato un'occupazione dei recettori incompleta, anche a dosaggi superiori di cetuximab, scoprendo come solo una frazione dei recettori fosse disponibile per il legame degli anticorpi. NanoBRET si è quindi dimostrata un'utile tecnica di imaging non invasiva per stabilire relazioni dose-risposta per il legame di cetuximab all'EGFR. Ciò che gli autori dello studio fanno notare è come il metodo possa essere generalizzato per lo studio dell'efficacia e della tossicità di altri anticorpi terapeutici.
Un altro possibile approccio NanoBRET consiste nel fondere una proteina bioluminescente con una fluorescente. Un esempio è lo sviluppo del sistema reporter Antares, in cui NanoLuc® viene fusa con due copie della proteina fluorescente arancione ciano eccitabile 1 (Cy-OFP1). Un approccio ben raccontato in un articolo blog di Promega Connections. Yichi Su, del dipartimento di Neurobiologia dell'Università di Stanford (US), ha utilizzato il reporter Antares, insieme a un reporterfirefly tradizionale, per l'imaging in vivo su topi di due gruppi di cellule. Lo studio ha permesso di misurare la dimensione del tumore, oltre che di osservare la migrazione delle cellule T del recettore chimerico dell'antigene (CAR).
Ti è piaciuto questo articolo? Condividilo!