Articoli correlati
Luciferasi NanoLuc®: il futuro luminoso dell'imaging in vivo ›
Notice: Promega will be performing essential system updates January 21–25.
Order processing and shipping will pause starting January 21 at 4:00 PM CST and resume on January 26.
Please plan to order in advance for any products needed during this timeframe.
Please contact Customer Service with any questions.
Grazie per aver verificato il tuo indirizzo email.
C'è stato un errore nella verifica dell'indirizzo email. Riprova o contatta il servizio clienti
23.05.22 – Giacomo Grisafi
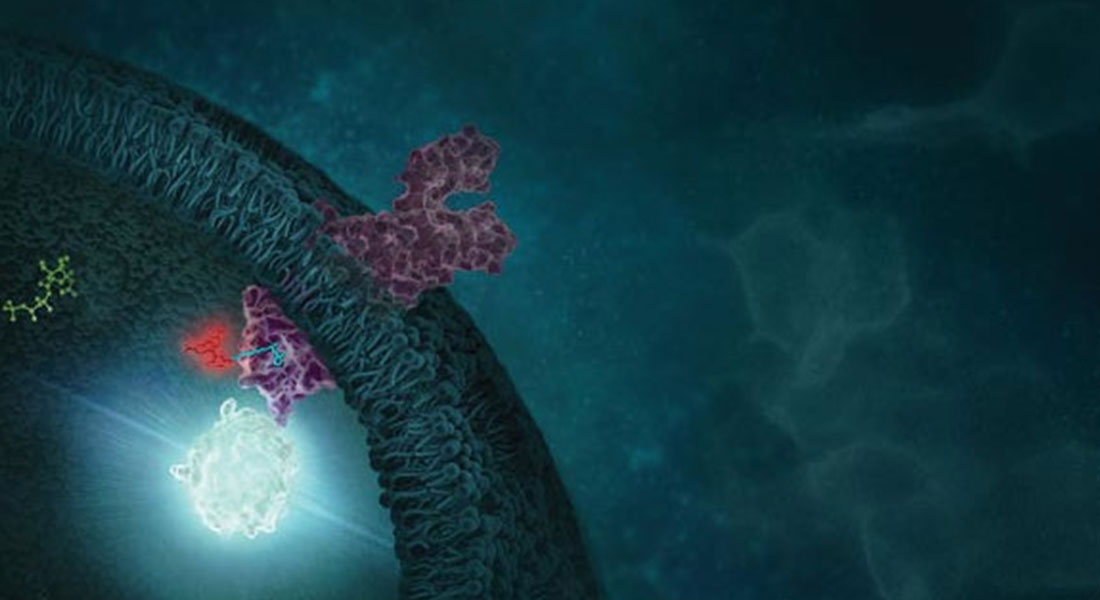
Uno studio pubblicato sulla rivista Nature Chemical Biology spiega come la proteina mutata più comune nel cancro potrebbe non essere così "undruggable" come si crede. Gli scienziati Promega hanno collaborato con il gruppo di ricerca guidato da Kevan Shokat - Università della California - allo sviluppo di strategie che hanno come bersaglio le proteine mutanti di KRAS finora non trattabili con la farmacologia convenzionale. Lo studio potrebbe aprire un ampio spettro di possibilità nello sviluppo di inibitori per KRAS(G12D) e altri mutanti patogenetici.
KRAS è una piccola GTPasi - enzima che idrolizza GTP - che funziona da interruttore principale per la proliferazione cellulare. Quando incorrono alcune mutazioni, l'azione di KRAS perde la sua regolazione e rimane costitutivamente attiva, portando le cellule a crescere e dividersi in modo incontrollato. Diversi studi hanno provato come almeno il 15% di tutti i tumori umani coinvolga una mutazione KRAS "attivante".
Sfortunatamente, KRAS è notoriamente difficile da bersagliare utilizzando farmaci tradizionali (small molecules). Questo perché si tratta di una proteina dalla forma globulare e senza caratteristiche particolari che la possano rendere inattivabile. Per questo è da tempo considerata come "undruggable". Solo nel 2013 il team guidato da Shokat ha stravolto questo paradigma dimostrando come KRAS(G12C), un mutante in cui un amminoacido glicina viene sostituito con una cisteina, sia suscettibile ad inibitori non covalenti. Queste molecole si legano a una regione chiamata switch-II pocket (SII-P) rendendo improvvisamente possibile lo sviluppo di diversi inibitori specifici per KRAS(G12C). A chiusura del cerchio, a maggio 2021 la FDA ha approvato Sotorasib, il primo inibitore di KRAS.
Lo studio di Nature Chemical Biology dimostra come ligandi non covalenti possano accedere ai SII-P di molti mutanti KRAS. Il loro legame al target è indipendente dallo stato del GDP della proteina e si traduce in una diminuzione della proliferazione cellulare.

Il team ha utilizzato la spettroscopia di risonanza magnetica nucleare (NMR) per valutare il legame di un gruppo di ligandi KRAS wild type (WT), KRAS(G12C) e KRAS(G12D). Il risultato? I ligandi in grado di legarsi in modo covalente a KRAS(G12C) hanno mostrato un'affinità non covalente per KRAS WT e KRAS(G12D) nello stato inattivo, ma non nei loro stati attivi legati al GTP. Inoltre, il team ha anche analizzato i composti sviluppati dall'azienda americana Mirati Therapeutics - noti per inibire il KRAS(G12D) - scoprendo come abbiano un'affinità non covalente per gli stati legati al GDP e al GTP di KRAS WT e KRAS(G12D).
In seguito, i ricercatori hanno utilizzato la tecnologia NanoBRET Target Engagement per quantificare il binding di KRAS in vivo. Il saggio utilizza il trasferimento di energia della bioluminescenza (BRET) per misurare quantitativamente il legame al bersaglio, l'affinità composto-bersaglio, il tempo di residenza del composto sul bersaglio e la permeabilità del composto in cellule vitali. La proteina target viene espressa in forma ricombinante, fusa alla luciferasi NanoLuc®, e al campione viene aggiunto un tracer fluorescente permeabile alle cellule che si lega in modo reversibile il target e compete con i composti in esame. Quando il tracciante si trova in prossimità di NanoLuc® genera un segnale BRET che può essere misurato tramite un lettore di piastre GloMax® Discover. Quando un composto compete con il tracciante, il segnale viene perso. Il test si basa su cellule vitali, producendo risultati che replicano con precisione il modo in cui un composto si comporta nella complessità di un sistema fisiologico, offrendo un risultato molto più informativo di analisi biochimiche.
La tecnologia NanoBRET Target Engagement ha aiutato il team di ricerca a capire come MRTX-EX185 sia estremamente potente contro KRAS(G12D), così come contro molti altri mutanti clinicamente rilevanti. Ulteriori analisi di vitalità effettuati con CellTiter-Glo 2.0 hanno poi dimostrato l'effetto antiproliferativo generato da questo legame.
Come riconoscono gli autori in un commento pubblicato sulla rivista Nature Chemical Biology, i risultati di questo studio indicano che KRAS non sia più da ritenersi un target "undruggable", come erroneamente considerato per decenni. Le soluzioni riportate nel lavoro del team forniscono una strategia innovativa e replicabile per lo sviluppo di una nuova classe di farmaci. Gli autori sperano che il loro studio possa sostenere il futuro sviluppo di trattamenti più specifici per tutti quei tumori che coinvolgono mutazioni del KRAS.
Ti è piaciuto il nostro articolo? Condividilo!