Articoli correlati
Congelati nel tempo: l’RNA racconta i mammut ›
Notice: Promega will be performing essential system updates January 21–25.
Order processing and shipping will pause starting January 21 at 4:00 PM CST and resume on January 26.
Please plan to order in advance for any products needed during this timeframe.
Please contact Customer Service with any questions.
It looks like you are having trouble logging in, please try our dedicated login page.
Grazie per aver verificato il tuo indirizzo email.
C'è stato un errore nella verifica dell'indirizzo email. Riprova o contatta il servizio clienti
09.02.26 – Articolo di Shannon Sindermann, traduzione di Giacomo Grisafi

Che si tratti dei gradini ghiacciati pieni di trappole di Mamma ho perso l'aereo, del momento in cui Bambi scopre che le sue zampe non hanno alcuna trazione o di una scena di inseguimento nell'Era glaciale che sfida la gravità, il ghiaccio è da sempre la spalla comica di molti sceneggiatori (un po' come la classica buccia di banana). Ma nella vita reale, la situazione è un po' più dura (a volte letteralmente) di quanto il grande schermo ci faccia credere.
Non serve guardare i film sopra citati per sapere che il ghiaccio è scivoloso. Ma forse non tutti sanno perché sia scivoloso, né quanto tempo sia servito agli scienziati per arrivare a un consenso. I ricercatori sanno da tempo che la superficie del ghiaccio si comporta come se fosse ricoperta da uno strato microscopico "bagnato" che lubrifica il movimento. Ciò su cui hanno discusso per quasi 200 anni è cosa crei quello strato (3,4).
Proviamo a pensare alla questione come a un mistero da risolvere. Il ghiaccio è la scena del crimine. La tua dignità (e quella dei maldestri ladri di Mamma ho perso l'aereo) è la vittima. Ecco i principali sospettati.
Negli anni '50 dell'Ottocento, l'ingegnere James Thomson ipotizzò che la pressione esercitata dalla lama di un pattino potesse sciogliere la superficie del ghiaccio. La logica si basava sulla termodinamica: poiché l'acqua liquida è più densa del ghiaccio, comprimerla ne abbassa il punto di fusione. Il fratello di Thomson, William Thomson (Lord Kelvin), contribuì a confermare sperimentalmente la relazione tra pressione e punto di fusione (3).
Ma ecco il problema: la fusione per pressione agisce solo a temperature vicine allo 0 °C. Quando John Joly applicò successivamente questa teoria al pattinaggio (1886), stimò che la pressione esercitata dalle lame dei pattini potesse abbassare il punto di fusione a circa −3,5 °C. Ciò potrebbe spiegare lo scivolamento su un ghiaccio relativamente "caldo", ma non chiarisce la scivolosità quando la temperatura è ben al di sotto dello zero. Due esempi: il ghiaccio da hockey, vicino a circa −9 °C, e gli sciatori, che possono sciare in condizioni molto più rigide. A quelle temperature, la pressione necessaria per sciogliere la superficie sarebbe irrealisticamente alta. Quindi, la pressione può essere un fattore secondario vicino al punto di fusione, ma non può essere la causa principale nelle tipiche condizioni invernali (3,4).
Negli anni '30, Frank Bowden e T.P. Hughes sostennero che lo scivolamento generasse calore per attrito, fondendo la superficie e lasciando una sottile pellicola su cui era possibile scivolare. Testarono quindi l'attrito sul ghiaccio e sostennero che l'effetto dipendesse dalla capacità del materiale di scivolamento di condurre il calore (3,4).

Il problema è il tempismo: il ghiaccio è scivoloso a partire dall'istante in cui ci si mette piede sopra, prima ancora che ci sia stato il tempo per generare un calore da attrito significativo (4). E anche quando ci si muove, il riscaldamento per attrito presenta una lacuna logica: tende a riscaldare il ghiaccio dietro di sé, non necessariamente quello su cui si sta per scivolare (4).
Detto questo, l'attrito non è completamente escluso dalla lista dei sospettati. In condizioni climatiche più fredde, quando lo strato superficiale è più sottile, il movimento può comunque aggiungere calore e modificare la forma del ghiaccio, rendendo la superficie scivolosa più ampia. Quindi, l'attrito può essere un fattore secondario, soprattutto una volta che si è già in fase di scivolamento, ma non può essere l'unico fattore determinante (3,4).
Molto prima che qualcuno potesse avvalersi delle simulazioni molecolari, Michael Faraday conduceva esperimenti scientifici molto vittoriani sui cubetti di ghiaccio. Notò che due pezzi di ghiaccio possono congelarsi insieme quando vengono messi a contatto (regelazione) e ipotizzò quindi che sulla superficie del ghiaccio esistesse un sottile strato liquido anche al di sotto del punto di congelamento. Faraday non riuscì a spiegare completamente il perché, ma la sua idea ha resistito allo scorrere del tempo (3).
Ci sono voluti diversi anni prima che gli scienziati proponessero una spiegazione: le molecole presenti sulla superficie hanno meno vicini con cui legarsi, quindi sono meno vincolate al rigido reticolo cristallino. Ciò crea uno strato quasi liquido (QLL): non una pozza visibile, ma piuttosto una "zona morbida", molecolarmente sottile, più facile da tagliare (3,4).

La prefusione è ampiamente agevolata in prossimità del punto di fusione, ma non sempre spiega la scivolosità a temperature molto basse, lì dove la mobilità superficiale dovrebbe in realtà diminuire (3,4).
Plot twist: lo "strato umido" non è una texture unica!
Passiamo all'ultimo sospettato, tirato in ballo da recenti simulazioni e da un articolo pubblicato nel 2025 sulla rivista Physical Review Letters da Achraf Atila, Sergey Sukhomlinov e Martin H. Müser dell'Università del Saarland (Germania). La loro tesi centrale è che il ghiaccio può diventare scivoloso senza che il classico scioglimento sia il fattore principale (1,5).
Le molecole d'acqua sono dipoli (hanno estremità leggermente positive e leggermente negative). Quando il ghiaccio tocca un'altra superficie (come la suola di una scarpa o la base di uno sci), i dipoli nel ghiaccio interagiscono con le cariche o i dipoli presenti in quel materiale. Queste forze elettrostatiche possono "disturbare" la disposizione ordinata dei cristalli all'interfaccia, disordinandola meccanicamente in uno strato amorfo, simile a un liquido, man mano che lo scivolamento continua. Pensate: non "ghiaccio riscaldato in acqua", ma "ghiaccio spinto in un caos molecolare" (5).
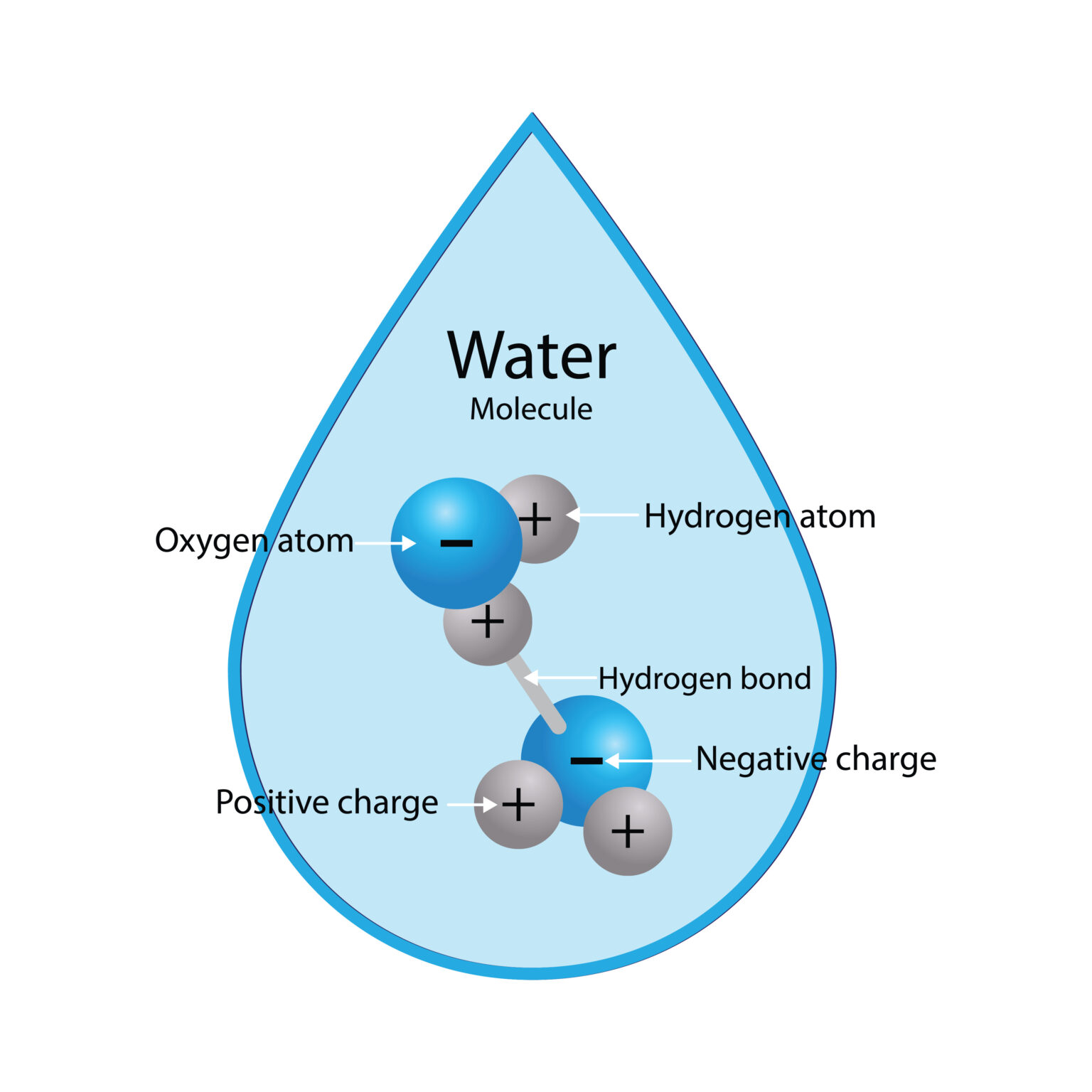
Questo meccanismo è particolarmente interessante perché spiega il comportamento scivoloso in condizioni climatiche più fredde, dove le semplici spiegazioni del tipo "si è sciolto" non sono sufficienti. Il team del Saarland sottolinea come questa pellicola interfacciale possa formarsi anche a temperature estremamente basse, sebbene diventi così viscosa da non sembrare acqua normale (1,5).
Se speravate in una spiegazione chiara e concisa, riassumibile in una sola riga, rimarrete delusi. Quello del ghiaccio è un caso piuttosto intricato: non si tratta di trovare un unico responsabile, quanto piuttosto "diversi complici" che collaborano tra loro. È stato recentemente definito un problema multi-meccanico in cui la pressione, il riscaldamento per attrito e la prefusione possono contribuire a seconda delle condizioni mentre, come abbiamo visto, lavori più recenti sostengono che l'interfaccia può anche "autolubrificarsi" attraverso il disordine e l'amorfizzazione durante lo scorrimento (1,3,4,5).
Conclusione: il ghiaccio è scivoloso perché la sua superficie è particolarmente facile da ammorbidire o disgregare in uno strato sottile e movibile, e perché ci sono diversi modi per provocare questo fenomeno, a seconda di quanto il contatto sia caldo, freddo, veloce e chimicamente "compatibile" (1,3,4,5).
Quindi, la prossima volta che vi trovate a ballare involontariamente la polka su un pezzo di ghiaccio, date la colpa alle molecole (e ai loro complici).
Ti è piaciuto il nostro articolo? Condividilo!